医药知识
从“魔法子弹”到“精准导弹”
1913年,免疫学先驱Paul Ehrlich首次提出了一个创新的设想,他称之为“魔法子弹”。这个概念主张有针对性地向特定目标细胞传递毒性药物,同时避免对正常细胞造成伤害。抗体药物偶联物(ADC)正是基于这一理念,通过特定的连接分子,将小分子毒素与抗体相结合,形成具有靶向性和杀伤力的药物。
事实上,ADC结构的成功实现却历经了近90年的发展:1958年科学家将甲氨蝶呤与抗体成功连接,使其可直接作用于细胞。1960s,因动物来源的抗体分离/提纯困难,首个ADC研发失败。1970s,单克隆抗体(mAb)技术解决了抗体纯化和免疫原性问题,因此共价结合的ADC得以开展动物实验。1980s,ADC开始用于肿瘤治疗的临床试验,首个ADC药物长春地辛抗体偶联物开始了临床试验。1990s,研究者发现鼠源mAb具有较高的免疫原性,严重限制了ADC的发展。2000s,新靶标和高效细胞毒药物的发现为ADC药物的发展提供了新的可能性。
历经87年的研究探索,2000年首个ADC药物Mylotarg获FDA批准用于用于治疗急性髓细胞白血病(AML)。经过近20年的沉淀,新技术和新型偶联形式的不断涌现为ADC药物带来了新生力量。2020年前后,ADC产品的上市迎来爆发期。到目前为止,中国获批上市的ADC药物有以下6个:
1. 罗氏—恩美曲妥珠单抗(T-DM1),靶点HER2,适应症为HER2阳性乳腺癌
2. Seagen/武田—维布妥昔单抗,靶点CD30,适应症为霍奇金淋巴瘤、系统性间变性大细胞淋巴瘤
3. 辉瑞—奥加伊妥珠单抗,靶点CD22,适应症为复发或难治性前体B细胞急性淋巴细胞白血病
4. 荣昌生物—维迪西妥单抗,靶点HER2,适应症为HER2阳性胃癌、尿路上皮癌
5. Immunomedics—戈沙妥珠单抗,靶点TROP-2,适应症为三阴性乳腺癌、尿路上皮癌
6. 阿斯利康/第一三共—德曲妥珠单抗,靶点HER2,适应症为HER2阳性乳腺癌、HER2低表达乳腺癌、HER2阳性胃癌
经过一百多年的发展,ADC药物已从襁褓阶段发展到了目前较为成熟的阶段。随着多款ADC药物的获批上市,科学家们将“魔法子弹”的理念变成了现实癌症治疗的“精准导弹”。
ADC—“靶向”与“强效”的完美结合
顾名思义,ADC由三部分组成:特异性抗体、连接子、细胞毒性药物,结构如图1所示。
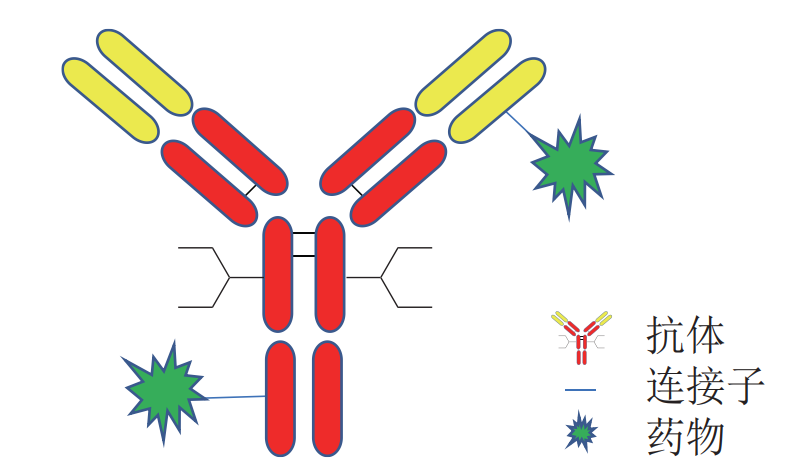
图1 ADC结构示意图(图片来源:参考文献1)
抗体是ADC的“导航系统”,能够精准识别癌细胞表面的特定抗原如HER2、CD30等,使得ADC通过内吞途径进入细胞内,通过溶酶体降解后,有效荷载被释放并发挥作用,引起癌细胞死亡。由于重组抗体技术的快速发展,各种更小的单抗形式(如Fab、scFv)现在已成为大分子IgG的替代。此外,科学家们正在开发和探索非IgG支架(如蛋白质和肽形式、小分子、适配体)。由于分子量较低且化学性质多样,这些新型偶联物与传统ADC相比,具有降低免疫原性和脱靶相互作用并增强肿瘤渗透性的潜力。
连接子是ADC的“稳定器”,在血液循环中保持药物稳定,到达“特定”位置后释放药物。药物何时何地释放取决于使用的连接子性质,连接子分为两类:其一是可裂解连接子:在癌细胞内特定条件下(如酸性环境或酶作用)断裂,释放药物;其二是不可裂解连接子:需要抗体被完全降解后才能释放药物。具体使用哪种类型的连接子需要根据靶标抗原的性质及代连接的药物结构综合确定。
细胞毒药物是ADC的“弹头”,通常是一种高效的小分子药物,能够破坏癌细胞的DNA或微管结构,导致细胞死亡。

图2 ADC作用机制(图片来源:参考文献2)
非内化ADC引领浪潮新风向
传统的ADC的有效性通常基于抗体和癌细胞表面的抗原结合后到达溶酶体,使药物受控释放。然而,药物释放效率低、免疫原性和毒性等方面的局限性限制了传统ADC在临床应用中的效果和安全性。为了克服这些限制,非内化ADC这种新开发方向应运而生。
非内化ADC的设计和开发并不依赖于癌细胞的内化过程,而是通过靶向癌细胞表面的非内化抗原来实现药物的定向输送和释放。与传统ADC相比,开发非内化ADC扩大了肿瘤靶点的范围,并避免对高抗原表达的依赖。此外,非内化ADC不需要溶酶体降解来释放有效载荷,因此其连接子可以设计为在细胞外肿瘤环境中不稳定。非内化ADC利用了癌症独特的化学或酶环境,不会在健康组织中裂解,因此可以降低毒性和副作用。最重要的是,非内化ADC可以最大化潜在的旁观者效应。
非内化ADC将靶点主要针对内吞差或者不内吞的靶抗原,这类靶抗原主要有膜蛋白类、肿瘤微环境类以及细胞外基质类。以细胞外基质成分为例,许多实体瘤中致密的细胞间基质阻碍大分子物质渗透到肿瘤深处,限制ADC治疗实体瘤的效果。非内化ADC在基质中积累可以使胞外载药在肿瘤微环境中释放,然后载药可以扩散到附近的肿瘤细胞,发挥强旁观者效应,改善活性药物对实体瘤的渗透性。典型的肿瘤细胞外基质靶点包括胶原蛋白、纤维蛋白、纤连蛋白、Tenascin-C,鉴于其足量、稳定性和选择性出现在肿瘤基质或血管中,它们成为非内化ADC的潜力靶点。
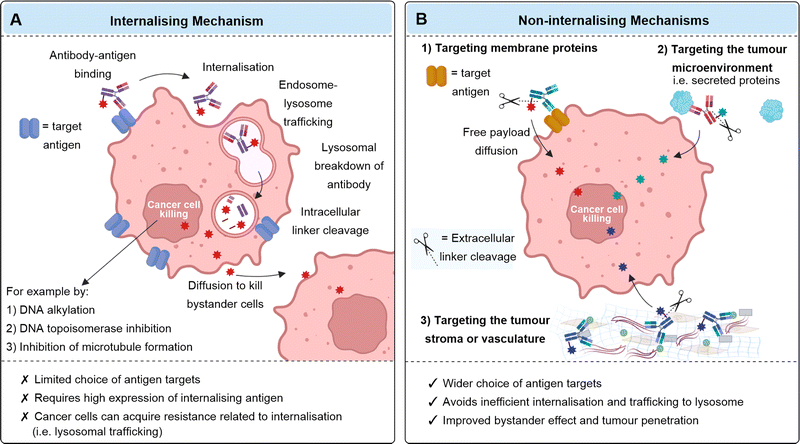
图3 内化ADC(A)和非内化ADC作用机制(B)对比(图片来源:参考文献3)
不断更迭,ADC的未来发展方向如何
尽管近十年来新开发的ADC在临床上取得了巨大成功,但它们在广泛用于抗癌治疗及其他领域时仍面临各种挑战如不良反应、肿瘤渗透不足、复杂的药代动力学和耐药性。未来ADC的发展将从以下三方面进行突破。
(1)设计创新
抗体方向:免疫原性降低,功能化增多
连接子方向:稳定性提高,特异性更好,载药量更高
载药方向:细胞毒效力增强
科学家正在持续研究ADC的新型结构、新型传递系统、非内化抗原靶点、新的细胞毒性药物和位点特异性生物偶联方法来促进ADC的发展。
(2)联合疗法
ADC与其他治疗方法(如免疫疗法、放疗)联合使用,可能产生协同效应,提高治疗效果。
(3)技术创新
ADC作为一类融合生物药与化学药的创新性治疗药物,其质量属性具有高度复杂性,涵盖了抗体制备、连接子合成、载药制备、ADC偶联、纯化及成品生产等多个关键环节。与传统生物制品相比,ADC在生产工艺、质量控制及放行检测等方面均存在显著差异,具有独特的技术挑战。未来,需进一步加强对ADC各风险环节的精细化控制,加速技术转化与实际应用,着力突破ADC制备与生产过程中的技术瓶颈,以推动其产业化发展。

图4 ADC回顾与展望(图片来源:参考文献4)
ADC代表了癌症治疗领域的一项重大突破,是人类智慧与癌症抗争的缩影。从最初的“魔法子弹”概念到如今的精准治疗工具,ADC为肿瘤治疗领域开辟了广阔的前景。虽然许多创新尚未在临床方案中得到验证,但这一领域的研究为我们提供了许多令人鼓舞的结果。相信ADC在不久的将来会迎来更加辉煌的前景。
参考文献
1.李明莹,汪琳,马宁宁.定点偶联技术在抗体药物偶联物中的应用[J].药学进展,2021,45(03):180-187.
2. Liu K, Li M, Li Y, et al. A review of the clinical efficacy of FDA-approved antibody‒drug conjugates in human cancers[J]. Molecular Cancer, 2024, 23(1): 62.
3. Ashman N, Bargh J D, Spring D R. Non-internalising antibody–drug conjugates[J]. Chemical Society Reviews, 2022, 51(22): 9182-9202.
4. Metrangolo V, Engelholm L H. Antibody–Drug Conjugates: The Dynamic Evolution from Conventional to Next-Generation Constructs[J]. Cancers, 2024, 16(2): 447.
【我们尊重原创,也注重分享。版权原作者所有,如有侵犯您的权益请及时联系,我们将第一时间删除。分享内容不代表本网观点,仅供参考。】

